| Avertissement ! Toutes les questions seront à choix multiples mais il se peut qu'il n'y ait qu'une seule bonne réponse ! |
Question 1
Retrouver la loi de Beer-Lambert
![]() A=k*C
A=k*C![]() K=A*C
K=A*C![]() K=A/C
K=A/C![]() K=C/A
K=C/A
Click here if you wish to read this hintK peut aussi s'écrire epsilon*lambda car epsilon et lambda ne changent souvent pas
Question 2
Retrouver la loi de Kohlrausch
![]() Sigma=k*C
Sigma=k*C![]() K=sigma*C
K=sigma*C![]() K=sigma/C
K=sigma/C![]() K=C/sigma
K=C/sigma
Question 3
Retrouver l'équation d'état du gaz parfait
![]() PV=nRT
PV=nRT![]() NPV=RT
NPV=RT![]() N=PV/RT
N=PV/RT![]() N=RT/PV
N=RT/PV![]() P=nRT/V
P=nRT/V![]() T=nPV/R
T=nPV/R
Question 4
En déduire la formule reliant quantité de matière, volume et volume molaire
![]() N=V/Vm
N=V/Vm![]() Vm=n*V
Vm=n*V![]() Vm=V/n
Vm=V/n![]() Vm=n/V
Vm=n/V![]() V=n*Vm
V=n*Vm
| Doc 1. |
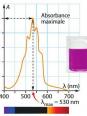
Question 5
Parmis le document 1 ci-dessus et la document 2 (image liée à cette question), relier quel doc est quel type de spectre
Question 6
Un dosage par étolonnage :
![]() Est réalisé en utilisant des solutions étalons
Est réalisé en utilisant des solutions étalons![]() Met en jeu une réaction chimique
Met en jeu une réaction chimique![]() Permet de déterminer la concentration d'une espèce chimique
Permet de déterminer la concentration d'une espèce chimique
Question 7
La droite d'étalonnage d'un dosage spectrophotométrique :
![]() Peut être exploitée avec la loi de Beer-Lambert
Peut être exploitée avec la loi de Beer-Lambert![]() A un coefficient directeur sans unité
A un coefficient directeur sans unité![]() Est la droite représentative de A = f(C)
Est la droite représentative de A = f(C)
Question 8
L'absorbance d'une solution colorée diluée est :
![]() Indépendante de l'espèce chimique absorbante
Indépendante de l'espèce chimique absorbante![]() Proportionnelle à la concentration en espèce absorbante
Proportionnelle à la concentration en espèce absorbante![]() Est un nombre sans unité
Est un nombre sans unité
Question 9
Le graphe ci-dessous a été obtenu lors d'un dosage par conductimétrie. Ce graphe :
Question 10
La conductivité d'une solution de concentration C en soluté est sigma=1.0 mS/cm. En exploitant le graphe ci-dessus, on détermine que :
![]() C = 4.0 mmol/L
C = 4.0 mmol/L![]() C = 4.0 mol/L
C = 4.0 mol/L![]() L'équation de la courbe est sigma=0.25*C
L'équation de la courbe est sigma=0.25*C![]() L'équation de la courbe est sigma=4.0*C
L'équation de la courbe est sigma=4.0*C
Question 11
L'équation d'état du gaz parfait :
![]() Est valable quelle que soit la pression du gaz
Est valable quelle que soit la pression du gaz![]() Permet de calculer une quantité de matière de gaz
Permet de calculer une quantité de matière de gaz![]() Est valable pour tous les gaz
Est valable pour tous les gaz
Question 12
Lors de l'utilisation de l'équation d'état du gaz parfait :
![]() La température doit être exprimée en °C
La température doit être exprimée en °C![]() Le volume doit être exprimé en L
Le volume doit être exprimé en L![]() La pression doit être exprimée en Pa
La pression doit être exprimée en Pa
Question 13
Pour calculer une quantité de matière n de gaz on peut utiliser la relation :
![]() N = C*V(solution)
N = C*V(solution)![]() N = V/Vm
N = V/Vm![]() N = PV/RT
N = PV/RT
Question 14
Le spectre UV-visible d'une molécule peut permettre :
![]() De déterminer les groupes caractéristiques qu'elle contient
De déterminer les groupes caractéristiques qu'elle contient![]() D'identifier sa chaine carbonée
D'identifier sa chaine carbonée![]() De l'identifier
De l'identifier
Question 15
Les bandes d'absorption du spectre IR d'une molécule de nombre d'onde supérieur à 1500/cm peuvent permettre :
![]() De déterminer les groupes caractéristiques qu'elle contient
De déterminer les groupes caractéristiques qu'elle contient![]() D'identifier sa chaine carbonée
D'identifier sa chaine carbonée![]() De l'identifier
De l'identifier
| Concernant les résultats : Je vous conseille de vous entrainez encore et encore si vous avez fait plus de 2 fautes à ce quiz. Comparé à celui-ci, les grosses interrogations risquent de vous écraser car les profs n'hésiteront pas à mettre le minimum de données, vous bloquant définitivement... |












Comments